Do otrzymania nanoproszków LiMPO4 (M= Mn, Co i Ni), LixMSiO4 zastosowano nowe metody syntezy wywodzące się z podejścia solwotermicznego, takie jak procesy jonotermiczne [Nytén, A. i in. (2005)] oraz materiały akumulatorowe z fluorofosforanami Li i Na [DiSalvo, FJ i in.
(1971); Ellis, BL i in. (2007b)] przy użyciu niskiej temperatury ogrzewania. Synteza jonotermiczna pojawiła się, gdy duża część prac badawczych była ukierunkowana na nowe, tanie procesy wytwarzania wysoce zoptymalizowanych elektrochemicznie materiałów elektrodowych. Ta alternatywna metoda jest uważana za nowy, niedrogi proces syntezy, ponieważ wymaga znacznie mniej energii niż metody ceramiczne wysokotemperaturowe. Pomimo wyższego kosztu cieczy jonowych w porównaniu z wodą, wykazano, że rozpuszczalniki te można ponownie wykorzystać bez oczyszczania, gdy zostaną użyte do przygotowania tego samego materiału, co prowadzi do znacznego obniżenia kosztów i minimalizuje powstawanie odpadów [Tarascon, JM. i in. (2010)]. Syntezę jonotermiczną przeprowadzono również z powodzeniem, stosując kuchenkę mikrofalową zamiast tradycyjnego ogrzewania, co skraca czas reakcji i energię wymaganą do syntezy.
Synteza jonotermiczna opiera się na zastosowaniu cieczy jonowej jako medium reakcyjnego zamiast wody w warunkach solwotermicznych. Ciecze jonowe stanowią klasę rozpuszczalników organicznych o wysokiej polarności i wstępnie zorganizowanej strukturze rozpuszczalnika [Del Popolo, MG i Voth, GA (2004)]. Ciecze jonowe o temperaturze pokojowej (lub zbliżonej do temperatury pokojowej) są klasycznie definiowane jako ciecze o temperaturze otoczenia (lub <100 °C), które składają się z kationów i anionów organicznych.
Mają doskonałe właściwości solwatujące, mało mierzalną prężność par i wysoką stabilność termiczną. Właściwości solwatujące i temperatury topnienia będą zależeć od wybranej kombinacji kationów i anionów. W dziedzinie inżynierii materiałowej pojawiło się kilka doniesień o zastosowaniu cieczy jonowych jako rozpuszczalników z bardzo małą lub kontrolowaną ilością wody zaangażowanej w syntezę [Antonietti, M i in. (2004)]. Większość tych badań skupiała się na materiałach amorficznych i nanomateriałach.
Podobnie jak woda, ciecze jonowe powstałe w wyniku zgodnych par kationowo-anionowych mają doskonałe właściwości rozpuszczalnika. Ponadto posiadają wysoką stabilność termiczną i znikomą lotność, dlatego stosowanie autoklawu nie jest obowiązkowe. Co więcej, ze względu na elastyczny charakter par kationowo-anionowych, stanowią one, jako rozpuszczalniki, ogromne możliwości celowego kierowania zarodkowaniem. W ciągu ostatniej dekady synteza jonotermiczna rozwinęła się w korzystną technikę syntezy do otrzymywania zeotypów [Lin, ZJ. i in. (2008)] i inne materiały porowate, takie jak metaloorganiczne związki szkieletowe (MOF), ale zastosowanie tej techniki w syntezie związków nieorganicznych jest bardzo ograniczone.
Unikalną cechą syntezy jonotermicznej jest to, że ciecz jonowa działa zarówno jako rozpuszczalnik, jak i dostawca matrycy. Wiele kationów cieczy jonowych jest pod względem chemicznym bardzo podobnych do związków, które są już znane jako dobre szablony (ciecze jonowe na bazie alkiloimidazolu i pirydyny). Wiele z nich to stosunkowo polarne rozpuszczalniki, dzięki czemu nadają się do rozpuszczania składników nieorganicznych wymaganych do syntezy. Jedną z charakterystycznych właściwości cieczy jonowych jest brak wykrywalnej prężności pary, co skutecznie eliminuje obawy dotyczące bezpieczeństwa związane z wysokimi ciśnieniami hydrotermalnymi, a także doprowadziło do ich zastosowania w syntezie mikrofalowej.
W procesie jonotermicznym, ponieważ do mieszaniny reakcyjnej nie dodaje się żadnych innych rozpuszczalników, teoria głosi, że nie występują żadne inne cząsteczki, które pełniłyby rolę wypełniaczy przestrzeni podczas syntezy. Oznacza to, że metoda jonotermiczna idealnie eliminuje konkurencję między interakcjami matryca – zręb i rozpuszczalnik – zręb, występującą w preparatach hydrotermalnych. Jest to jednak scenariusz idealistyczny, który nie zawsze jest możliwy do osiągnięcia ze względu na możliwy rozkład niewielkiej części kationów cieczy jonowej, w wyniku czego powstają mniejsze kationy matrycy, które mogą preferencyjnie działać jako czynnik kierujący strukturą w rozpuszczalniku cieczy jonowej [Parnham , ER i Morris, RE (2006)].
Najnowsze badania nad modelowaniem molekularnym wskazują, że struktury cieczy jonowych charakteryzują się korelacjami i rozkładami dalekiego zasięgu, które odzwierciedlają asymetryczne struktury kationów. Tego rodzaju asymetryczne efekty dalekiego zasięgu potencjalnie zwiększają prawdopodobieństwo przeniesienia informacji chemicznej z kationu matrycy do struktury zrębowej, co jest sytuacją pożądaną, jeśli ma zostać osiągnięta pełna kontrola nad procesem tworzenia szablonów [Parnham, ER i Morris, RE (2007). )].
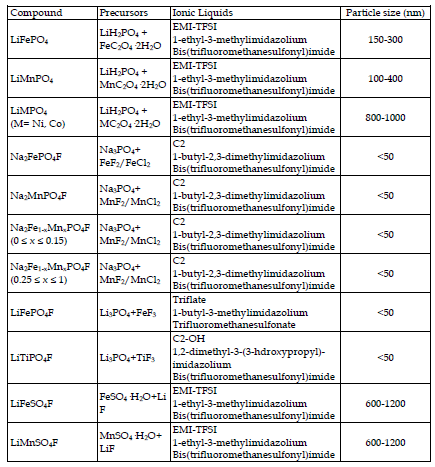
Tarascon i in. jako pierwsi zastosowali syntezę jonotermiczną do materiałów elektrod akumulatorowych. Przetestowali kilka cieczy jonowych na bazie różnych form kationowych i anionowych jako medium reakcyjne do przygotowania fazy LiFePO4 [Recham, N. i in. (2009a)]. Wykazano, że zastosowane ciecze jonowe mają wpływ na zarodkowanie/wzrost LiFePO4 i zachowują się jak czynnik kierujący strukturą. Na przykład, zastosowanie cieczy jonowej EMI-TFSI funkcjonalizowanej CN [bis(trifluorometanosulfonylo)imid 1-etylo-3-metyloimidazoliowy] doprowadziło do wytworzenia igiełkowatych proszków wzdłuż [010] kierunku, które idealnie ułożyły się w stos, tworząc większą igłę. Ta zmiana w grupie końcowej modyfikowała polarny charakter ośrodka reakcji i jego właściwości solwatujące, wpływając w ten sposób na wzrost kryształów. Cząstki podobne do płytek wzdłuż kierunku [020] utworzono poprzez zmniejszenie polarności poprzez zastosowanie kationu EMI na bazie C18. Powstawanie tych
dwóch rodzajów morfologicznych można wyjaśnić w kategoriach konkurencyjnych powierzchni energii i jest ono bezpośrednio związane z naturą cieczy jonowej, siłą solwatacji, polarnością i zdolnością do specyficznej absorpcji na jednej z powierzchni. W zależności od właściwości cieczy jonowej minimalizacja energii powierzchniowej układu będzie odbywać się poprzez inny mechanizm. Wszystkie materiały wytworzone przez LiFePO4 były elektrochemicznie aktywne, ale te o najlepszych parametrach miały rozmiary 300 i 500 nm i wykazywały pojemność właściwą 150 mAh·g-1 przy C/10 bez powłoki węglowej.
Proces jonotermiczny rozszerzono o syntezę fluorofosforanów na bazie Na o kontrolowanej wielkości [Na2MPO4F (M= Fe, Mn)] [Recham, N. i in. (2009b)]. Fazy te są atrakcyjnymi materiałami elektrodowymi, ponieważ bazują na ekonomicznych metalach i można je stosować zarówno w akumulatorach na bazie Li, jak i Na. Ponadto fluorki mają wyższą elektroujemność, co zwiększa jonowość wiązań, a tym samym ich potencjały redoks w wyniku efektu indukcyjnego. Nanopróbki Na2FePO4F i Na2MnPO4F o średnicy około 25 nm przygotowano w cieczy jonowej bis(trifluorometanosulfonyloimid) 1,2-dimetylo-3-butyloimidazoliowy, w przeciwieństwie do gruboziarnistych proszków otrzymywanych metodą ceramiczną. Właściwości elektrochemiczne związku żelaza osiągnęły lepsze wyniki niż materiału ceramicznego, przy 115 mAh·g-1, lepszej pojemności początkowej, niższej pojemności nieodwracalnej, niższej polaryzacji i lepszym zachowaniu pojemności. Faza manganowa nie wykazywała aktywności elektrochemicznej, co jest zgodne z ogólną tendencją związków na bazie manganu, które charakteryzują się gorszymi właściwościami elektrochemicznymi niż ich odpowiedniki Fe, np. w rodzinach LiMPO4 i Li2MSiO4. Z tym zjawiskiem wiążą się dwa czynniki. Po pierwsze, silne zniekształcenie Jahna-Tellera na Mn3+, które wpływa na jego sferę koordynacyjną; a po drugie, słabą przewodność elektronowo-jonową materiałów, ze względu na większą jonowość wiązania MO.
Proces jonotermiczny z powodzeniem zastosowano do otrzymania nowych, nieosiągalnych wcześniej materiałów elektroaktywnych, takich jak LiFeSO4F. Materiał ten posiada odpowiednią strukturę sprzyjającą migracji jonów Li wzdłuż kanałów. Ta faza elektroaktywna nie była wcześniej syntetyzowana, ponieważ nie jest dostępna ani w procesie ceramicznym, ani w środowisku wodnym. Rozkłada się w temperaturze powyżej 375°C i w środowisku wodnym. Ten nowy materiał katody wykazywał aktywność elektrochemiczną przy 3,6 V i odwracalną pojemność właściwą 140 mAh·g-1, bardzo blisko teoretycznej wartości pojemności właściwej wynoszącej 151 mAh·g-1. Zatem ten proces preparatywny okazał się użytecznym narzędziem do syntezy nowych i znanych materiałów elektroaktywnych o wielkości nano.
